病毒
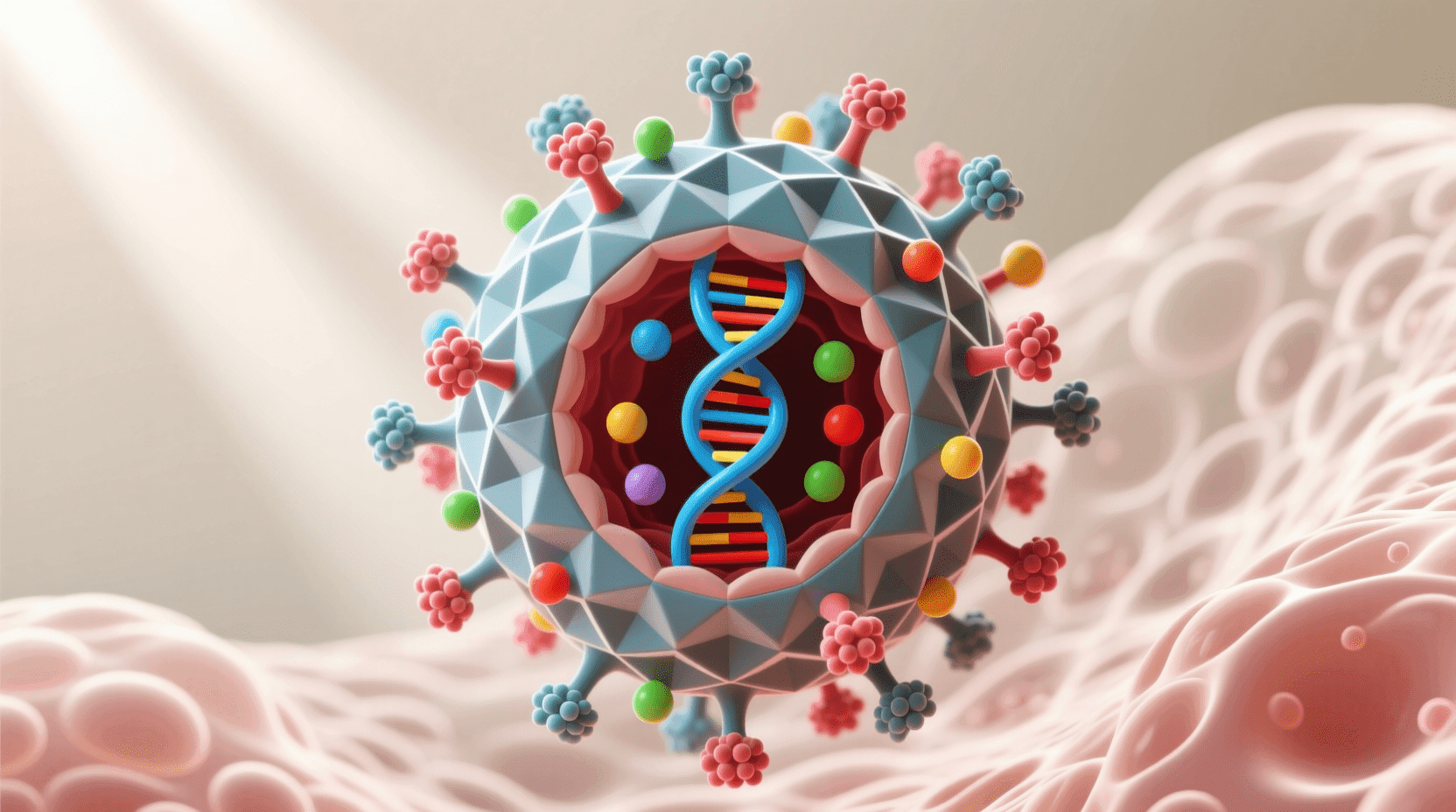
在我们肉眼看不见的微观世界里,存在着一类特殊的“生物”——它们既不能独立生存,也不能进行新陈代谢,却能够在宿主细胞内大量复制并传播疾病。这就是病毒,一种介于生命体和非生命体之间的奇特存在。
与细菌和真核细胞相比,病毒显得极其简单。它们只是由遗传物质(DNA或RNA)包裹在蛋白质外壳中形成的感染性颗粒。最小的病毒直径仅有20纳米,比细胞内的核糖体还要小,而最大的病毒直径也只有1500纳米,在光学显微镜下几乎看不见。
病毒无法独立进行生命活动,只能在宿主细胞内“借用”细胞的分子机器来复制自己,这就是为什么科学家们称它们过着“借来的生活”。
病毒是否算作生命体?这个问题至今仍然困扰着生物学家。早期科学家将病毒视为生物化学物质,“病毒”这个词在拉丁语中原本就是“毒药”的意思。虽然病毒能够导致各种疾病,19世纪末的研究者认为它们可能是最简单的生命形式。然而,现代生物学家普遍认为,由于病毒无法在宿主细胞外进行繁殖或代谢活动,它们并不能算作真正的生物,而是存在于生命体和化学物质之间的灰色地带。
病毒的发现历程
烟草花叶病之谜
19世纪80年代,植物叶片上的一场奇怪病变吸引了科学家的注意。1883年,德国的阿道夫·迈尔在研究烟草花叶病现象时意识到,这种呈现不规则斑驳的病症可以通过涂抹患病植物叶汁给健康植株而传播。
尽管迈尔努力用显微镜寻觅细菌的存在,却未能有所发现。他因此认为应该有极其微型的细菌作祟,只是超出了当时仪器的探测范围。十年后,这一观点迎来了新一轮的科学检验。
颠覆性的过滤实验
进入1892年,俄国学者德米特里·伊万诺夫斯基开展了决定性实验。他将病叶汁液透过滤菌的瓷质过滤器,按理说所有细菌都应被阻挡。让人惊讶的是,过滤后的滤液依旧可以传染健康植物。
伊万诺夫斯基仍然认为细菌是罪魁祸首,猜测过滤器也许未能过滤体积极小的细菌,或者这些细菌释放了某种具传染性的毒素。然而,来自荷兰的马尔蒂努斯·贝叶林克展开了一系列新实验,逐步推翻了这种假设。
贝叶林克的实验证明,过滤性传染因子可以在活体植物内增殖,却无法象细菌那样在培养基中繁殖。在那个年代,这一神秘因子无论在外形还是行为上都与细菌截然不同,贝叶林克据此首次明确提出了“病毒”这一全新概念。
贝叶林克以一种全新视角看待这种病原体——它既不属于细菌,也无法在常规环境中生长,只能在活的宿主体内完成自身复制。直到1935年,美国的温德尔·斯坦利首次将这种具有感染性的颗粒提纯结晶,我们终于首次“看见”了烟草花叶病毒(TMV)。电子显微镜的发明,也让病毒这一神秘世界彻底展现在世人眼前。
病毒的基本结构
核酸基因组的多样性
我们通常认为基因是由双链DNA构成的,但病毒却打破了这个常规。根据病毒类型的不同,它们的基因组可能由双链DNA、单链DNA、双链RNA或单链RNA构成。病毒根据其核酸类型被分类为DNA病毒或RNA病毒。
病毒基因组通常以单个线性或环形核酸分子的形式存在,不过有些病毒的基因组由多个核酸分子组成。最小的病毒基因组只包含三个基因,而最大的则可能包含几百到2000个基因。相比之下,细菌基因组通常包含200到几千个基因。
蛋白质外壳的精巧设计
包围病毒基因组的蛋白质外壳被称为衣壳。根据病毒类型的不同,衣壳可能呈杆状、多面体状或更复杂的形状。衣壳由大量称为衣壳蛋白的蛋白质亚基构建而成,但衣壳中不同类型蛋白质的数量通常很少。
烟草花叶病毒具有刚性的杆状衣壳,由超过1000个单一类型蛋白质分子以螺旋形式排列而成;因此,杆状病毒通常被称为螺旋病毒。腺病毒感染动物的呼吸道,它们有252个相同的蛋白质分子排列成具有20个三角形面的多面体衣壳——二十面体;因此,这类病毒和其他类似形状的病毒被称为二十面体病毒。
病毒包膜的特殊功能
一些病毒具有帮助它们感染宿主的附属结构。例如,膜状包膜包围着流感病毒和许多其他在动物中发现的病毒的衣壳。这些病毒包膜来源于宿主细胞的膜,含有宿主细胞的磷脂和膜蛋白。它们还含有病毒来源的蛋白质和糖蛋白。一些病毒在其衣壳内携带少量病毒酶分子。
最复杂的衣壳见于感染细菌的病毒,称为噬菌体或简称噬菌体。最早研究的噬菌体包括7个感染大肠杆菌的噬菌体。这7个噬菌体按发现顺序被命名为1型(T1)、2型(T2)等等。三个“T偶”噬菌体(T2、T4和T6)在结构上非常相似。它们的衣壳具有包围其DNA的细长二十面体头部。头部连接着一个蛋白质尾部,噬菌体通过尾部纤维附着到细菌细胞上。
病毒结构的精巧设计体现了自然界“少即是多”哲学——用最少的组件实现最高效的感染和复制。
病毒如何复制
病毒感染的基本过程
病毒本身缺乏制造蛋白质的代谢酶和设备,如核糖体。它们是专性细胞内寄生生物,换句话说,它们只能在宿主细胞内复制。可以说,孤立状态下的病毒只是一组打包好的基因,正在从一个宿主细胞转运到另一个宿主细胞的途中。
每种特定的病毒只能感染有限数量的宿主物种,这被称为病毒的宿主范围。这种宿主特异性源于病毒进化出的识别系统。病毒通常通过病毒表面蛋白与细胞外侧特定受体分子之间的“锁和钥匙”配合来识别宿主细胞。
根据一种理论模型,这些受体分子最初执行有益于宿主细胞的功能,但后来被病毒"劫持"作为入侵门户。有些病毒具有广泛的宿主范围,例如,西尼罗病毒和马脑炎病毒是两种截然不同的病毒,它们都能感染蚊子、鸟类、马和人类。其他病毒的宿主范围如此狭窄,以至于它们只感染单一物种。
例如,麻疹病毒只能感染人类。此外,多细胞真核生物的病毒感染通常仅限于特定组织。人类感冒病毒只感染上呼吸道细胞的内壁,而本节开头图中看到的HIV只与某些类型免疫细胞上存在的受体结合。
病毒复制的一般特征
病毒感染始于病毒与宿主细胞结合,病毒基因组进入细胞内部。基因组进入的机制取决于病毒类型和宿主细胞类型。例如,T偶噬菌体使用其复杂的尾部装置将DNA注入细菌。其他病毒通过内吞作用被摄取,对于包膜病毒,则是通过病毒包膜与宿主细胞质膜融合。
一旦病毒基因组进入内部,它编码的蛋白质就能“指挥”宿主,将细胞重新编程以复制病毒基因组并制造病毒蛋白质。宿主为制造病毒核酸提供核苷酸,还提供制造病毒蛋白质所需的酶、核糖体、tRNA、氨基酸、ATP和其他组件。
许多DNA病毒使用宿主细胞的DNA聚合酶沿着病毒DNA提供的模板合成新基因组。相比之下,为了复制其基因组,RNA病毒使用病毒编码的RNA聚合酶,这些酶能够使用RNA作为模板。(未感染的细胞通常不制造执行此过程的酶。)
病毒核酸分子和衣壳蛋白产生后,它们自发地自组装成新的病毒。事实上,研究人员可以将TMV的RNA和衣壳蛋白分离,然后在适当条件下简单地将组件混合在一起,重新组装成完整的病毒。
最简单类型的病毒复制循环以成百上千的病毒从被感染的宿主细胞中释放出来而结束,这个过程往往损坏或破坏细胞。这种细胞损伤和死亡,以及机体对这种破坏的反应,造成了与病毒感染相关的许多症状。从细胞中释放出来的病毒后代有可能感染其他细胞,传播病毒感染。
噬菌体的复制机制
噬菌体是所有病毒中了解最深入的,尽管其中一些也是最复杂的。对噬菌体的研究导致发现一些双链DNA病毒可以通过两种不同的机制复制:裂解循环和溶原循环。
裂解循环
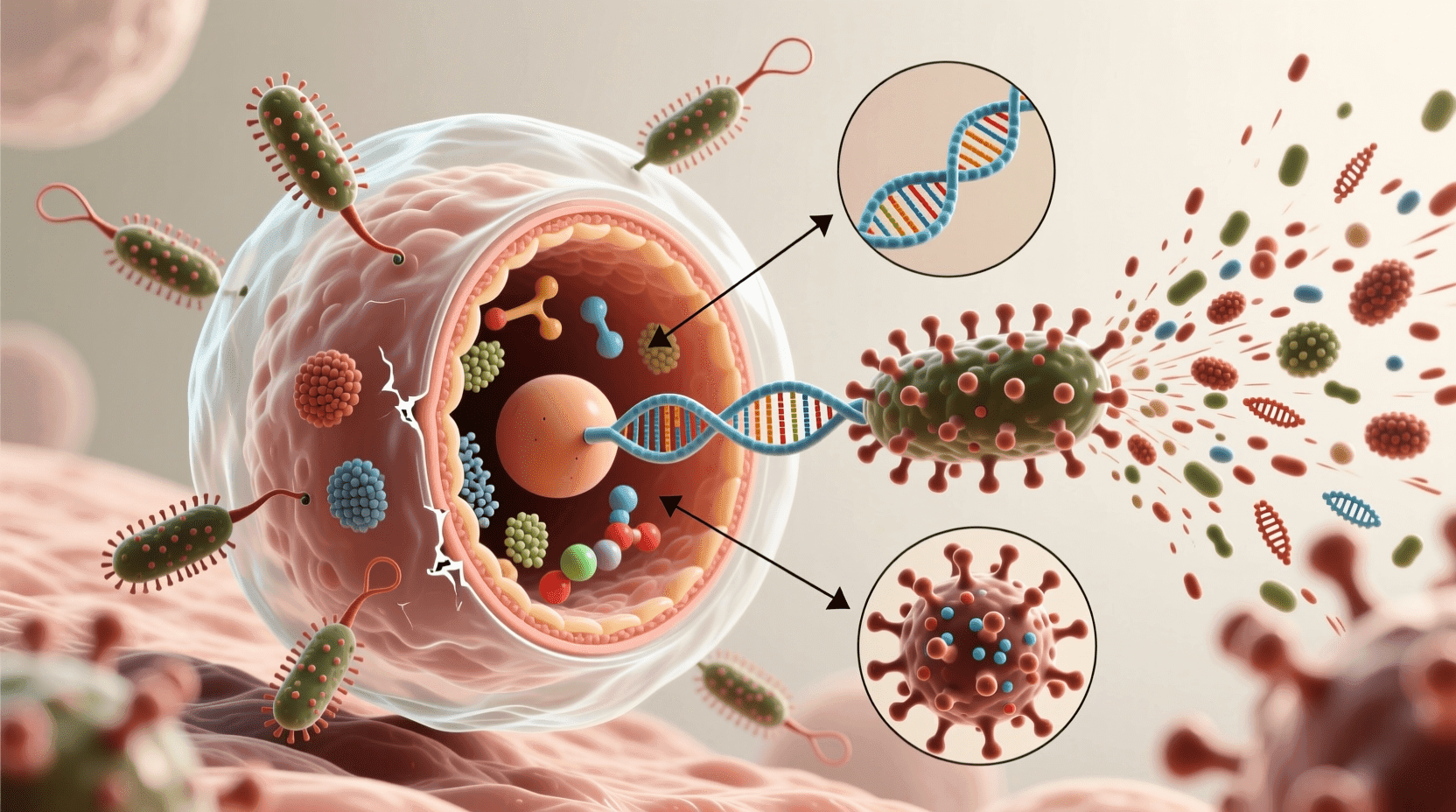
以宿主细胞死亡为终结的噬菌体复制循环被称为裂解循环。这个术语指的是感染的最后阶段,在此期间细菌裂解(破裂)并释放在细胞内产生的噬菌体。每个这样的噬菌体都能感染健康细胞,几个连续的裂解循环可以在短短几个小时内摧毁整个细菌群体。只通过裂解循环复制的噬菌体是毒性噬菌体。
典型毒性噬菌体T4的裂解循环包含以下主要步骤:
噬菌体T4有近300个基因,这些基因使用宿主细胞的机器进行转录和翻译。病毒DNA进入宿主细胞后翻译的首批噬菌体基因之一编码一种降解宿主细胞DNA的酶;噬菌体DNA受到保护不被分解,因为它含有一种修饰形式的胞嘧啶,不被噬菌体酶识别。整个裂解循环,从噬菌体首次接触细胞表面到细胞裂解,在37°C时仅需20-30分钟。
溶原循环
许多噬菌体不是裂解宿主细胞,而是与它们共存于一种称为溶原性的状态。与杀死宿主细胞的裂解循环相比,溶原循环允许噬菌体基因组复制而不破坏宿主。能够在细菌内使用两种复制模式的噬菌体称为温和噬菌体。
广泛用于生物学研究的温和噬菌体叫做λ(lambda,希腊字母λ)。噬菌体λ类似于T4,但其尾部只有一根短尾纤维。大肠杆菌细胞被噬菌体λ感染始于噬菌体与细胞表面结合并注入其线性DNA基因组。在宿主内,λ DNA分子形成环形。接下来发生的事情取决于复制模式:裂解循环还是溶原循环。
在溶原循环中,λ DNA分子通过病毒蛋白质整合到大肠杆菌染色体的特定位点,这些蛋白质打断两个环形DNA分子并将它们相互连接。当以这种方式整合到细菌染色体中时,病毒DNA被称为前噬菌体。
前噬菌体的一个基因编码一种蛋白质,阻止大多数其他前噬菌体基因的转录。因此,噬菌体基因组在细菌内大多保持沉默。每当大肠杆菌细胞准备分裂时,它都会复制噬菌体DNA以及自己的染色体,这样每个子细胞都继承一个前噬菌体。
单个被感染的细胞可以迅速产生携带前噬菌体形式病毒的大量细菌群体。这种机制使病毒能够传播而不杀死它们依赖的宿主细胞。
溶原性一词意味着前噬菌体能够产生裂解其宿主细胞的活性噬菌体。当λ基因组(或另一个温和噬菌体的基因组)被诱导离开细菌染色体并启动裂解循环时,就会发生这种情况。某种化学物质或高能辐射等环境信号通常会触发从溶原模式到裂解模式的转换。
除了编码防止转录的病毒蛋白质的基因外,在溶原期间还可能表达其他一些前噬菌体基因。这些基因的表达可能改变宿主的表型,这种现象在医学上具有重要意义。例如,引起人类白喉、肉毒杆菌中毒和猩红热疾病的三种细菌物种,如果没有某些前噬菌体基因导致宿主细菌制造毒素,对人类的危害就不会那么大。
细菌对噬菌体的防御机制
阅读了关于裂解循环的内容后,您可能会想知道为什么噬菌体没有消灭所有细菌。溶原性是细菌免遭噬菌体导致灭绝的一个主要原因。细菌也有自己对抗噬菌体的防御机制。
首先,自然选择偏爱那些表面蛋白质不再被特定类型噬菌体识别为受体的细菌突变体。其次,当噬菌体DNA确实进入细菌时,这些DNA往往被识别为外来物质并被称为限制性酶的细胞酶切割,这些酶之所以这样命名,是因为它们限制了噬菌体在细菌内复制的能力。细菌自身的DNA以一种防止其自身限制性酶攻击的方式被甲基化。
第三种防御机制是细菌和古菌中都存在的CRISPR-Cas系统。CRISPR-Cas系统是在研究许多原核生物基因组中存在的重复DNA序列时发现的。这些令科学家困惑的序列被命名为成簇规律间隔短回文重复序列(CRISPR),因为每个序列正反读都相同(回文),重复序列之间有不同的“间隔DNA”片段。
起初,科学家认为间隔DNA序列是随机和无意义的,但几个研究小组的分析表明,每个间隔序列都对应于曾经感染过该细胞的特定噬菌体的DNA。进一步的研究表明,特定的核酸酶蛋白质与CRISPR区域相互作用。这些核酸酶,称为Cas(CRISPR相关)蛋白质,能够识别和切割噬菌体DNA,从而保护细菌免受噬菌体感染。
当具有CRISPR-Cas系统的细菌细胞被噬菌体感染时,入侵噬菌体的DNA被整合到基因组中两个重复序列之间。如果细胞在感染中存活下来,同一类型噬菌体再次感染该细胞(或其后代)的任何进一步尝试都会触发CRISPR区域转录成RNA分子。
这些RNA被切成片段,然后被Cas蛋白结合。Cas蛋白使用一部分与噬菌体相关的RNA作为归巢装置来识别入侵的噬菌体DNA并将其切割,导致其被破坏。
正如自然选择偏爱那些受体因突变而改变或具有能切割噬菌体DNA的酶的细菌一样,它也偏爱那些能够结合到改变的受体或对酶具有抗性的噬菌体突变体。因此,细菌-噬菌体关系处于不断的进化变化中。
病毒性疾病及其防控
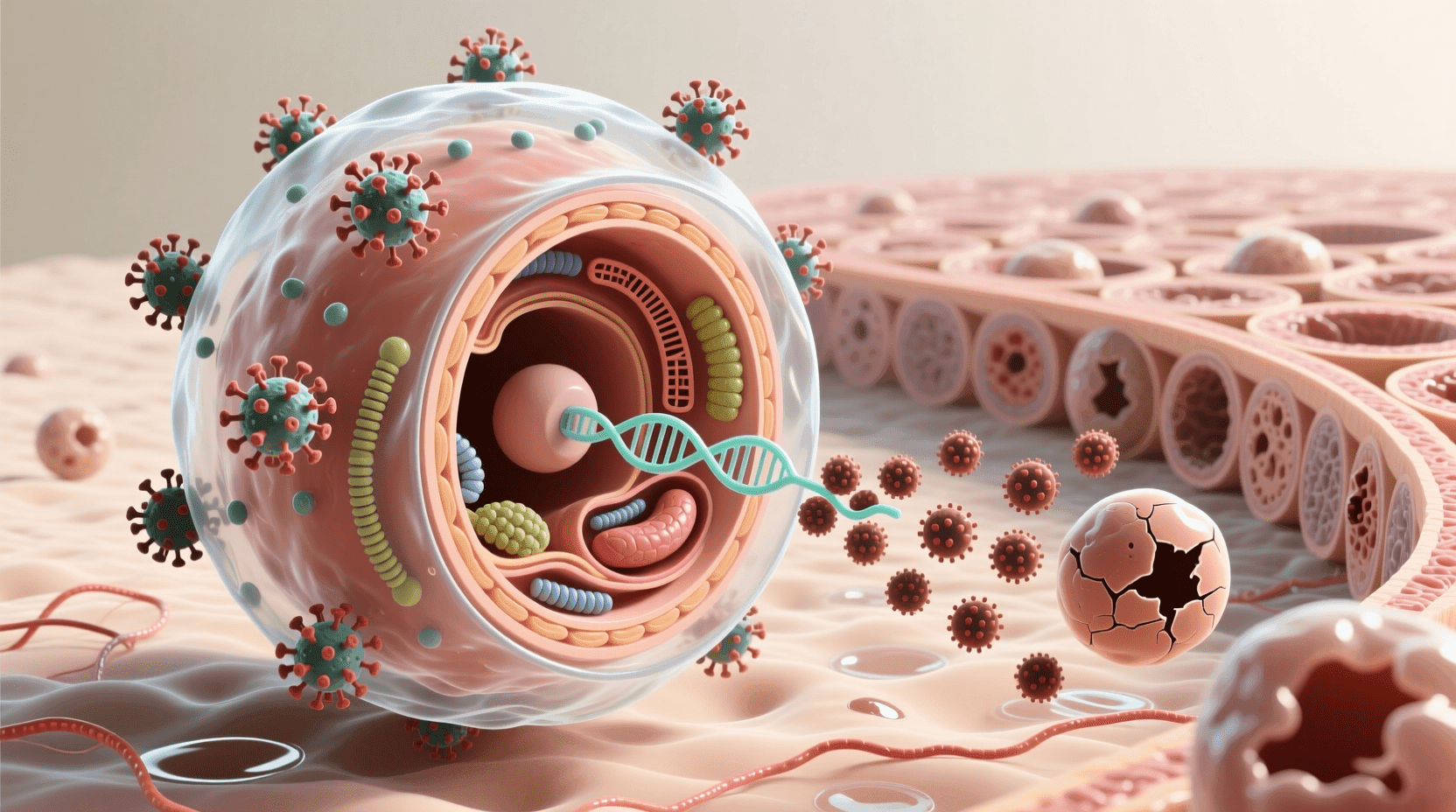
动物病毒的感染机制
每个人都曾患过病毒感染,无论是感冒、流感还是普通的感冒。像所有病毒一样,那些在人类和其他动物中引起疾病的病毒只能在宿主细胞内复制。动物病毒在病毒感染和复制的基本模式上表现出许多变化。一个关键变量是病毒基因组的性质(双链或单链DNA或RNA)。另一个变量是是否存在膜状包膜。
虽然很少有噬菌体具有包膜或RNA基因组,但许多动物病毒两者都有。事实上,几乎所有具有RNA基因组的动物病毒都有包膜,具有DNA基因组的一些病毒也是如此。
病毒感染可以通过多种不同途径产生症状。病毒可能通过引起溶酶体释放水解酶来损害或杀死细胞。一些病毒导致受感染的细胞产生引起疾病症状的毒素,有些病毒具有毒性的分子成分,如包膜蛋白。病毒造成多少损害部分取决于受感染组织通过细胞分裂再生的能力。
人们通常能从感冒中完全康复,因为病毒感染的呼吸道上皮能够有效地自我修复。相比之下,脊髓灰质炎病毒对成熟神经细胞的损害是永久性的,因为这些细胞不分裂,通常无法被替换。与病毒感染相关的许多暂时症状,如发热和身体疼痛,实际上是机体自身抵抗感染的努力的结果,而不是病毒引起的细胞死亡。
疫苗
免疫系统是机体天然防御的关键部分。它也是用于预防病毒感染的主要医疗工具——疫苗的基础。疫苗是病原体的无害衍生物,能刺激免疫系统建立对有害病原体的防御。
天花这种曾经在世界许多地区造成毁灭性破坏的病毒性疾病,通过世界卫生组织开展的疫苗接种计划得以根除。天花病毒极窄的宿主范围——它只感染人类——是这一计划成功的关键因素。类似的全球疫苗接种运动目前正在进行,以根除脊髓灰质炎和麻疹。针对风疹、腮腺炎、乙型肝炎和许多其他病毒性疾病也有有效的疫苗。
中国在疫苗研发和接种方面取得了显著成就。特别是在新冠疫情期间,中国快速研发出多款有效疫苗,为全球抗疫做出了重要贡献。
虽然疫苗可以预防某些病毒性疾病,但目前医疗护理对大多数病毒感染一旦发生几乎无能为力。对抗细菌感染的抗生素对病毒无效。抗生素通过抑制细菌特有的酶来杀死细菌,但对真核细胞或病毒编码的酶没有影响。
然而,仅由病毒编码的少数酶为其他药物提供了靶点。大多数抗病毒药物类似于核苷,因此会干扰病毒核酸合成。一种这样的药物是阿昔洛韦,它通过抑制合成病毒DNA但不抑制真核病毒DNA的病毒聚合酶来阻碍疱疹病毒复制。
新发病毒的威胁与应对
突然出现的病毒通常被称为新发病毒。HIV这种AIDS病毒就是一个经典例子:这种病毒在1980年代初期出现在旧金山,似乎凭空出现,尽管后来的研究发现了1959年在比利时刚果的一个病例。许多其他危险的新发病毒会导致脑炎,即大脑炎症。
2003年的SARS疫情给中国带来了巨大挑战,也积累了宝贵的防控经验。从SARS到H7N9禽流感,再到新冠肺炎,中国在应对新发病毒方面形成了一套完整的体系。
这些病毒如何突然出现在人类舞台上,引起以前罕见甚至未知的有害疾病?三个过程促成了病毒性疾病的出现。第一个,也许是最重要的,是现有病毒的突变。RNA病毒往往具有异常高的突变率,因为病毒RNA聚合酶不校对和纠正其RNA基因组复制中的错误。
一些突变将现有病毒转变为新的遗传变种(毒株),这些毒株可能引起疾病,即使在对祖先病毒免疫的个体中也是如此。例如,季节性流感流行是由流感病毒的新毒株引起的,这些毒株在遗传上与早期毒株足够不同,以至于人们对它们几乎没有免疫力。
第二个可能导致病毒性疾病出现的过程是病毒性疾病从小的、孤立的人群中传播。例如,AIDS几十年来一直没有名字,几乎没有引起注意,然后才开始在世界各地传播。在这种情况下,技术和社会因素,包括负担得起的国际旅行、输血、性滥交和静脉注射药物滥用,使以前罕见的人类疾病成为全球灾难。
人类病毒性疾病的第三个来源是现有病毒从其他动物的传播。科学家估计,大约四分之三的新人类疾病以这种方式起源。能够携带和传播特定病毒但通常不受其影响的动物被称为该病毒的天然宿主库。例如,引起前面提到的2009年流感大流行的H1N1病毒很可能从猪传给人类;因此,它引起的疾病最初被称为“猪流感”。
总的来说,流感流行为病毒在物种间移动的影响提供了一个有启发性的例子。有三种类型的流感病毒:B型和C型,它们只感染人类且从未引起流行病,以及A型,它感染包括鸟类、猪、马和人类在内的广泛动物。在过去100年中,甲型流感毒株在人类中引起了四次重大流感流行。最严重的是第一次,即1918-1919年的"西班牙流感"大流行,造成4000-5000万人死亡,包括许多第一次世界大战士兵。
甲型流感的不同毒株被给予标准化名称;例如,引起1918年流感和2009年大流行流感的毒株都被称为H1N1。该名称标识存在两种病毒表面蛋白质的哪种形式:血凝素(HA)和神经氨酸酶(NA)。有16种不同类型的血凝素(一种帮助流感病毒附着到宿主细胞的蛋白质)和9种神经氨酸酶类型(一种帮助从受感染细胞释放新病毒粒子的酶)。已经发现水鸟携带具有HA和NA所有可能组合的病毒。
气候变化对全球病毒传播的潜在影响已引起科学家的关注。登革热等蚊媒病毒已出现在佛罗里达州和葡萄牙等以前未见过的地区,这可能表明携带这些病毒的蚊虫物种由于全球气候变化而扩大了活动范围。
植物病毒与农业安全
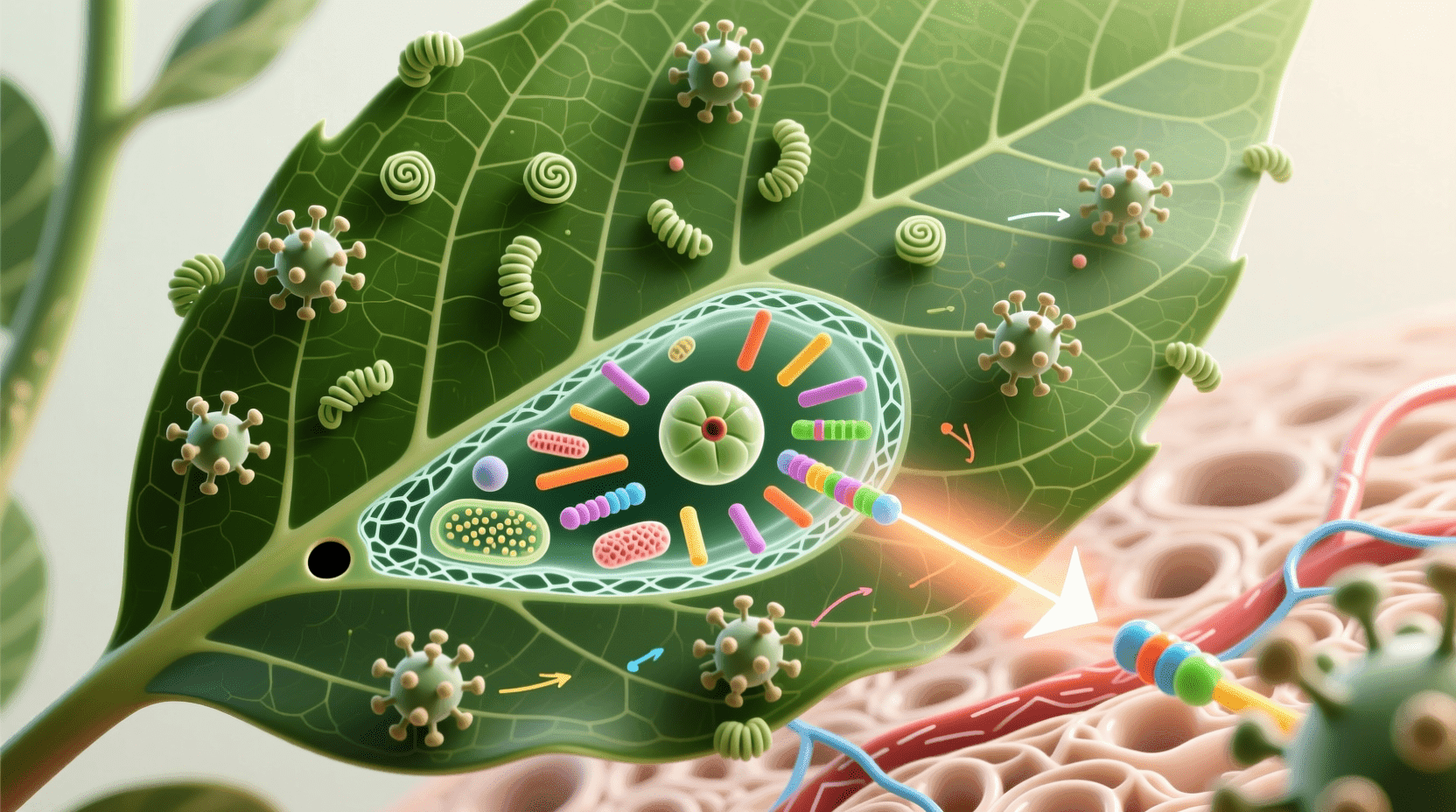
植物病毒的危害与传播
植物病毒疾病超过2000种,全球每年因农作物和园艺作物遭到破坏而造成的经济损失估计达150亿美元。病毒感染的常见征象包括叶片和果实上的漂白或褐色斑点、生长发育迟缓、花朵或根部受损,所有这些都会降低作物的产量和质量。
在中国,水稻条纹花叶病毒、番茄黄化曲叶病毒和马铃薯Y病毒等植物病毒每年给农业生产造成巨大损失。仅以水稻为例,病毒病害可导致减产10%-30%,严重时甚至颗粒无收。
植物病毒具有与动物病毒相同的基本结构和复制模式。迄今为止发现的大多数植物病毒,包括烟草花叶病毒(TMV),都具有RNA基因组。许多植物病毒像TMV一样具有螺旋衣壳,而其他植物病毒具有二十面体衣壳。
植物的病毒性疾病通过两个主要途径传播。第一个途径称为水平传播,植物从病毒的外部来源受到感染。由于入侵病毒必须绕过植物细胞的外层保护层(表皮),如果植物受到风、外伤或食草动物的损伤,就更容易受到病毒感染。
食草动物,特别是昆虫,构成双重威胁,因为它们也可以充当病毒载体,将疾病从植物传播到植物。此外,农民和园丁可能在修剪剪刀和其他工具上无意中传播植物病毒。病毒感染的另一个途径是垂直传播,其中植物从亲本那里继承病毒感染。垂直传播可以在无性繁殖(例如,通过插条)或通过受感染种子的有性繁殖中发生。
一旦病毒进入植物细胞并开始复制,病毒基因组和相关蛋白质就可以通过胞间连丝在整个植物中传播,胞间连丝是穿透相邻植物细胞壁之间的胞质连接。病毒大分子从细胞到细胞的通过由病毒编码的蛋白质促进,这些蛋白质导致胞间连丝扩大。
科学家还没有为大多数植物病毒疾病设计出治疗方法。因此,研究工作主要集中在减少此类疾病的传播和培育抗性作物品种上。
中国植物病毒防控的成功实践
中国在植物病毒防控方面积累了丰富经验。例如,通过选育抗病品种,我国成功控制了水稻条纹花叶病的流行;通过推广生物防治技术,有效减少了蔬菜病毒病的发生;通过建立监测预警体系,及时发现并控制了多起新发植物病毒病害。
朊病毒
朊病毒的独特性质
在本节讨论的病毒都是传播疾病的感染因子,它们的遗传物质由核酸组成,其复制能力是众所周知的。令人惊讶的是,还有一些已知具有感染性的蛋白质。称为朊病毒的蛋白质似乎会引起各种动物物种的多种退行性脑病。这些疾病包括绵羊的瘙痒病;近年来困扰欧洲牛肉业的疯牛病;以及人类的克罗伊茨费尔特-雅各布病,自1996年以来已在英国导致约175人死亡。
朊病毒可以通过食物传播,就像人们食用患有疯牛病的牛的含朊病毒牛肉时可能发生的那样。另一种由朊病毒引起的人类疾病库鲁病,在1900年代初期在新几内亚的南福尔土著人中被发现。库鲁流行在那里在1960年代达到顶峰,令科学家困惑,他们起初认为该疾病具有遗传基础。
朊病毒具有两个特别令人担忧的特征:首先,朊病毒作用非常缓慢,在出现症状之前有至少十年的潜伏期;其次,朊病毒几乎是不可摧毁的,正常烹饪温度下的加热无法破坏或使其失活。
最终,人类学调查发现了疾病的传播方式:仪式性食人,这在当时南福尔土著人中是一种广泛的做法。朊病毒有两个特别令人担忧的特征。首先,朊病毒作用非常缓慢,在出现症状之前有至少十年的潜伏期。漫长的潜伏期防止了在首批病例出现很久之后才识别感染源,从而允许发生更多感染。其次,朊病毒几乎是不可摧毁的;正常烹饪温度下的加热不会破坏或使其失活。
朊病毒致病机制
一种无法自我复制的蛋白质怎么可能是可传播的病原体?根据主流模型,朊病毒是通常存在于脑细胞中的蛋白质的错误折叠形式。当朊病毒进入含有正常形式蛋白质的细胞时,朊病毒以某种方式将正常蛋白质分子转换为错误折叠的朊病毒版本。然后几个朊病毒聚集成一个复合体,该复合体可以将其他正常蛋白质转换为朊病毒,从而加入链条。朊病毒聚集干扰正常细胞功能并引起疾病症状。
这个模型在1980年代初由斯坦利·普鲁西纳首次提出时遭到了很多怀疑,但现在已被广泛接受。普鲁西纳因其朊病毒研究工作于1997年获得诺贝尔奖。他最近提出朊病毒也参与阿尔茨海默病和帕金森病等神经退行性疾病。关于这些小感染因子仍有许多悬而未决的问题。
病毒的进化意义
我们通过询问病毒是否活着开始了本内容。病毒确实不符合我们对生物体的定义。孤立的病毒在生物学上是惰性的,无法复制其基因或再生自己的ATP。然而,它确实具有用生命的通用语言编写的遗传程序。
我们是将病毒视为自然界最复杂的分子缔合还是最简单的生命形式?无论哪种方式,我们都必须调整我们通常的定义。虽然病毒无法独立复制或进行代谢活动,但它们使用遗传密码使得很难否认它们与生物世界的进化联系。
病毒与其宿主细胞基因组之间持续的进化关系是一种关联,使病毒在分子生物学中继续成为非常有用的实验系统。关于病毒的知识也允许许多实际应用,因为病毒通过引起疾病的能力对所有生物体产生巨大影响。
病毒研究不仅帮助我们理解生命的本质,更为疾病防控、基因工程和生物技术发展提供了重要工具和理论基础。
病毒如何起源?已经发现感染每种生命形式的病毒——不仅是细菌、动物和植物,还有古菌、真菌、藻类和其他原生生物。因为它们依赖细胞进行自己的繁殖,病毒似乎不太可能是前细胞生命形式的后代,而是在第一个细胞出现后进化的——可能是多次进化的。
大多数分子生物学家倾向于病毒起源于从一个细胞移动到另一个细胞的裸核酸片段的假设,也许是通过受伤的细胞表面。编码衣壳蛋白基因的进化可能使病毒能够结合细胞膜,从而促进对未受伤细胞的感染。
病毒基因组的原始来源的候选者包括质粒和转座子。质粒是在细菌和称为酵母的单细胞真核生物中发现的小环状DNA分子。质粒存在于细菌染色体之外,可以独立于细菌染色体复制,偶尔在细胞之间转移。转座子是可以在细胞基因组内从一个位置移动到另一个位置的DNA片段。因此,质粒、转座子和病毒都共享一个重要特征:它们是移动遗传元件。
与DNA从细胞转移到细胞这一概念一致的是,病毒基因组与其宿主的基因组比与感染其他宿主的病毒基因组有更多的共同点。事实上,一些病毒基因与宿主的基因基本相同。关于病毒起源的争论大约在15年前因为发现迄今为止最大病毒之一的报告而重新点燃:Mimivirus是一种双链DNA(dsDNA)病毒,具有直径400纳米的二十面体衣壳,相当于一个小细菌的大小。
它的基因组包含120万个碱基(Mb)——大约是流感病毒基因组的100倍——以及估计1000个基因。然而,mimivirus最令人惊讶的方面可能是其基因组包括以前只在细胞基因组中发现的基因。其中一些基因编码参与翻译、DNA修复、蛋白质折叠和多糖合成的蛋白质。
mimivirus是在第一个细胞之前进化然后与它们发展剥削关系,还是最近进化并简单地从其宿主那里清除基因,这个问题尚未解决。自2013年以来,已经发现了几种甚至更大的病毒,无法用任何现有已知病毒进行分类。这些和所有其他病毒如何适应生命之树是一个有趣的、未解决的问题。
通过深入了解病毒的世界,我们不仅能更好地理解生命的复杂性和多样性,还能为应对未来可能出现的新病毒威胁做好准备。病毒学的发展将继续为人类健康、农业安全和生物技术进步做出重要贡献。