量子力学与生物遗传

在当代生物学的前沿研究中,随着X射线衍射等先进物理技术的广泛应用,生物学家与物理学家的合作使我们对基因分子的空间尺度有了越来越精细的测量。让人惊异的是,这些决定生命遗传信息的分子结构,其实规模非常微小,通常只由大约上千个原子甚至更少的组成。然而,就是这样一个“微观机器”,却表现出惊人的秩序、准确的自复制能力以及时空上极为罕见的稳定性。
依照经典物理学的观点,任何系统都会受到热扰动的影响,其有序结构理应被逐渐打破,趋向于混乱和无序——这是热力学第二定律的核心思想。
我们可以用真实的历史案例来感受这种规律性在遗传中的神奇体现。比如,中国明代皇室特殊的面部遗传特征“朱氏下颌”,几乎跨越了整个王朝几百年,其现象不仅清晰地保存在皇帝画像中,也让后人对遗传的精准与稳定性心生诧异。想想一个微小的遗传信息可以通过几十代人的细胞复制和环境扰动,依然几乎毫无偏差地传承下来,这已经远远超越了日常化学稳定性的概念。
遗传稳定性引发的概率悖论
让我们进一步思考:人体内部温度恒定地维持在37°C,细胞分裂无时无刻不在进行,每一次复制都伴随着激烈的分子热运动与无数次碰撞。那么为何那些负责特定遗传特征的基因片段,即便经过上亿次复制循环,依然能长久地保有自身结构与功能?从统计物理的角度来看,这几乎是不可想象的。
指标统计物理结论,微观结构在长时间的热力学扰动下应不可避免地失去其有序排列——但现实却给出了完全相反的证据。
在十九世纪末,科学家们面对上述困惑时,所能寄望的也只是分子间某种不明原因的高稳定性。虽然化学已清楚描述了分子的存在与性质,但分子为何能如此坚固,原子间究竟以何种方式紧密“握手”,这些仍是当时难以解答的谜团。可以说,那时的“分子”不过是经验事实背后的黑盒罢了。
量子力学解锁遗传稳定性奥秘
直到量子物理的诞生,人们才终于有能力深入理解微观世界的秩序与稳定。遗传结构之所以能保存上百年、千年,其根本原因就在于量子世界的规则主宰着原子和分子的行为。我们甚至可以说,没有量子理论,现代分子生物学乃至遗传学的发展都难以想象。
从普朗克揭示能量量子化起,科学的脚步带来了巨大变革;与此同时,遗传学方面,孟德尔的法则和后续突变理论的提出也揭示了生命信息的离散性。这两个学科的伟大发现几乎同步,这并非巧合——两者都指向了“单位化”的本质,即无数微观离散单元通过严谨规则拼合出宏大且稳定的体系。直至1920年代末,化学结合的量子理论(海特勒-伦敦模型)才为我们解释了分子的稳定性与变化机制,为基因的精确复制与突变机制奠定了基础。
海特勒-伦敦工作提供了第一个真正用量子力学解释化学键的理论框架,而正是这种化学键的微观稳定性成为了遗传信息得以长期保存和稳定表达的基石。正是在这之中,量子跃迁、微小能级变化背后,隐藏了基因突变的深层量子物理机制。
量子理论的深刻洞见
量子力学与经典物理最大的不同,在于它揭示了自然界的本质具有“离散性”,这与我们肉眼看到的连续世界截然不同。比如,在能量层面,微观系统并不是可以任意连续地改变能量,而只能存在于一些“被允许”的特定能量级上。这类似于楼梯——你只能站在台阶上,无法悬浮在两级之间。
经典物理的例子中,如钟摆的运动速率可连绵变化;但在原子和分子的世界里,能量的变化无法无缝连接,只能“跳跃”式地从一个状态转换到另一个状态,这种转变常被称为量子跃迁。
量子化的普适性及其对生命的意义
其实被量子化的不仅仅是能量。系统的其他自由度——比如分子运动的振动方式、电子自旋、光的偏振方向等等——在微观尺度下也受到离散化规则的严格约束。正像我们能随意摆动天花板吊球的运动方向一样,在宏观世界似乎一切皆可连续变化,但当尺度缩小到原子、分子的层次时,所有这些“配置”都只能在有限个量子态之间切换。
也正因如此,生物大分子才能经受高温、碰撞等剧烈环境变动而不轻易畸变,保障了基因信息能够被万无一失地复刻与传承。微观离散性的量子特质,为生命复杂性提供了根本的稳定机制,成为遗传现象得以长存不变的重要物理基础。
原子系统的离散状态组合与量子约束
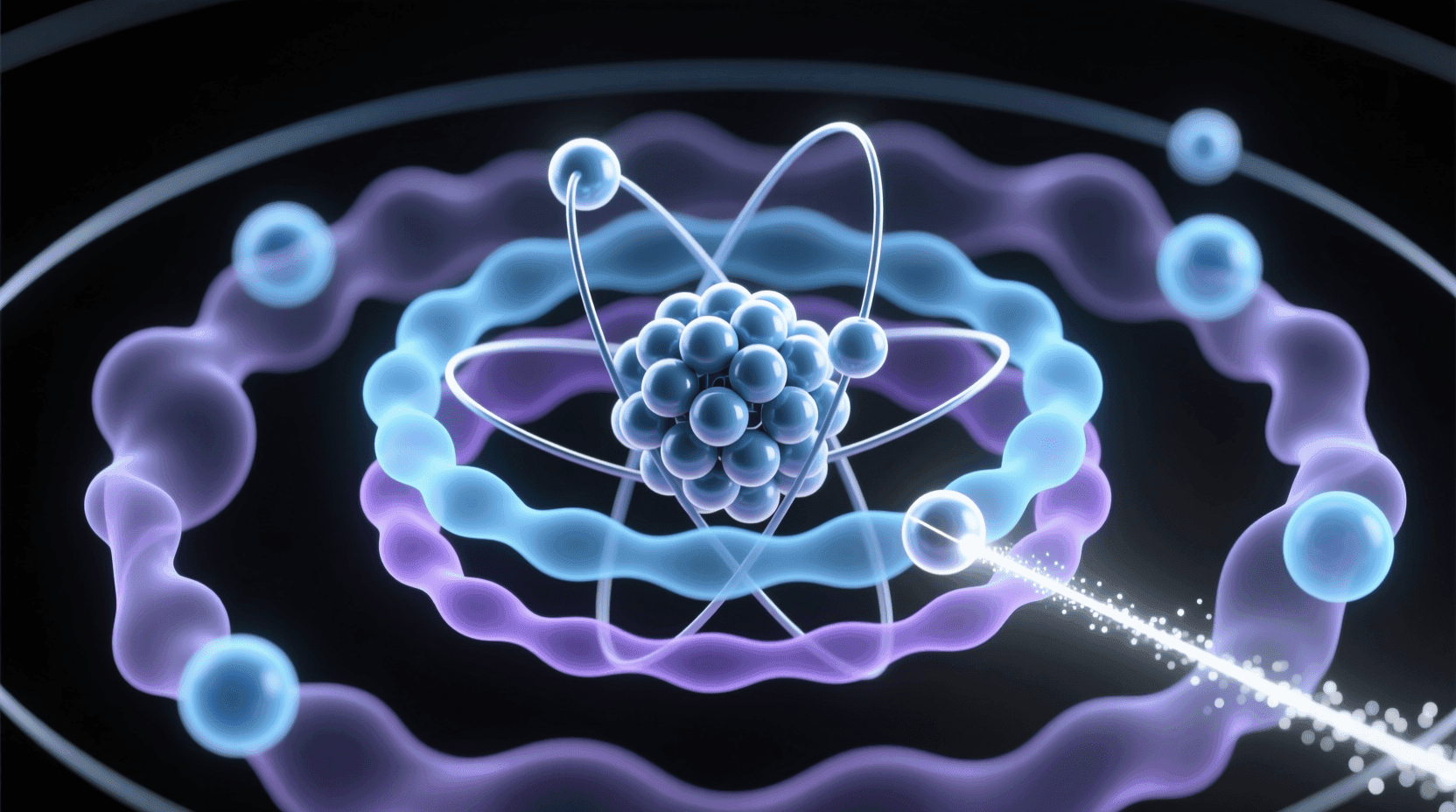
当我们深入观察多个原子核及其电子云在空间中相互接近时,会发现一个令人着迷的现象:这些微观粒子并非可以随意排列组合,而是受到严格的量子力学约束。就像一个精密的三维拼图,每个原子只能占据特定的“允许位置”,形成我们所说的量子态。
这种约束的根源在于波函数的叠加原理和泡利不相容原理。电子作为费米子,不能占据完全相同的量子态,这就像一个看不见的“交通规则”,规定了电子在原子轨道中的分布模式。当多个原子靠近时,它们的电子云会发生重叠和相互作用,产生新的分子轨道,而这些轨道的能量是严格量子化的。

